記者黃翊婷/綜合報導
美國食品藥物管理局(FDA)批准輝瑞BNT疫苗藥證,這也意味後續藥商可以直接向BNT進貨。對此,食藥署藥品組科長黃玫甄表示,過去審查藥品有120天、180天和240天的機制,若有治療嚴重疾病、國內迫切需求等因素,且通過美國和歐盟認證,通常可縮短成120天,如果有藥商想申請新冠肺炎相關疫苗,有望能採用專案審查開啟「綠色通道」,所需時間可能會更短。
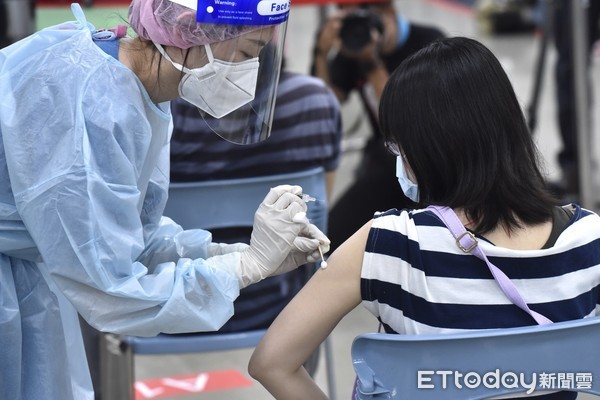
▲國產高端疫苗23日開打,對於未來還有哪些疫苗會在何時到貨,也是大眾相當關心的焦點。(圖/記者李毓康攝)
美國正式核准BNT疫苗取得藥證,意味未來疫苗進貨有望可以不經過政府,直接向輝瑞BNT洽購,台灣製藥公司保瑞率先表態有意願代理BNT疫苗。對此,中央流行疫情指揮中心指揮官陳時中表示,目前沒有這樣的變化,採購疫苗單位仍以政府為主,就算BNT取得美國藥證,但要進入台灣就要取得台灣藥證,須由分公司或代理商提出。
食藥署藥品組科長黃玫甄也提到,現在如果有廠商申請一定會加速處理,就算美國審查意見可以參考,但還是要看廠商資料齊全狀況,可以來申請的藥商包含在國內登記的製造業或者販賣業藥商,醫療院所不行,地方政府也不行,而取得藥品許可證要附GDP申請文件、藥品優良運輸規範文件,才能提出。
至於審查時間方面,根據食藥署網站公布的新藥查驗登記精簡審查機制規範,分為第一類精簡審查和第二類精簡審查,詳細如下:
第一類精簡審查:屬新成分新藥,具有美國FDA、歐盟EMA或日本 MHLW其中兩地區核准證明,經評估未具族群差異者,查驗登記審查天數縮短為180天。
第二類精簡審查:屬新成分新藥,具有美國FDA、歐盟EMA及日本 MHLW核准證明且化學製造管制(CMC)資料皆相同,經評估未具族群差異者,查驗登記審查天數縮短為120天。
▲美國食品藥物管理局(FDA)批准輝瑞BNT疫苗藥證。(圖/路透)
黃玫甄說,走精簡審查最長時間有120天、180天和240天,適用條件不同,如果是美國、歐盟已經通過者,且有治療嚴重疾病、國內有迫切需求,會有優先審查機制,屬於120天,若是歐美沒通過,但有迫切需求者,會適用240天。
但黃玫甄強調,這些都是一般藥品狀況,新冠疫苗可能會以專案方式開啟「綠色通道」來做,優先處理,所需時間有望能再縮短,至於詳細的審查時間要多久,則要視資料齊全程度而定,無法精準預估。









讀者迴響